ひろまる先生
この記事では,水溶液の1つである質量パーセント濃度に関する計算問題について学習していきます.
溶質・溶媒・溶液と質量パーセント濃度のまとめ
インスタにもまとめました.
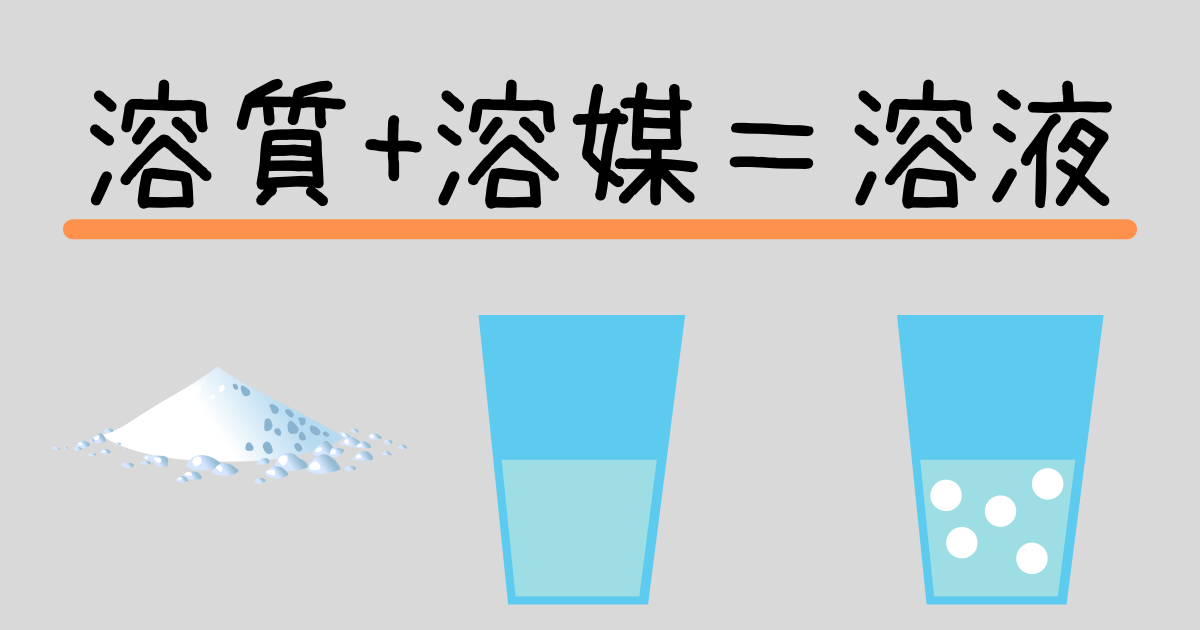
溶質・溶媒・溶液とは

いきなりですが,目の前にココア,砂糖水,炭酸水があるとします。
それぞれ、何が溶けているかわかりますか?
ココア ➡︎ ココアパウダー
砂糖水 ➡︎ 砂糖
炭酸水 ➡︎ 二酸化炭素
砂糖水に注目してみましょう.
砂糖を水に溶かすことで,砂糖水を作ることができます.
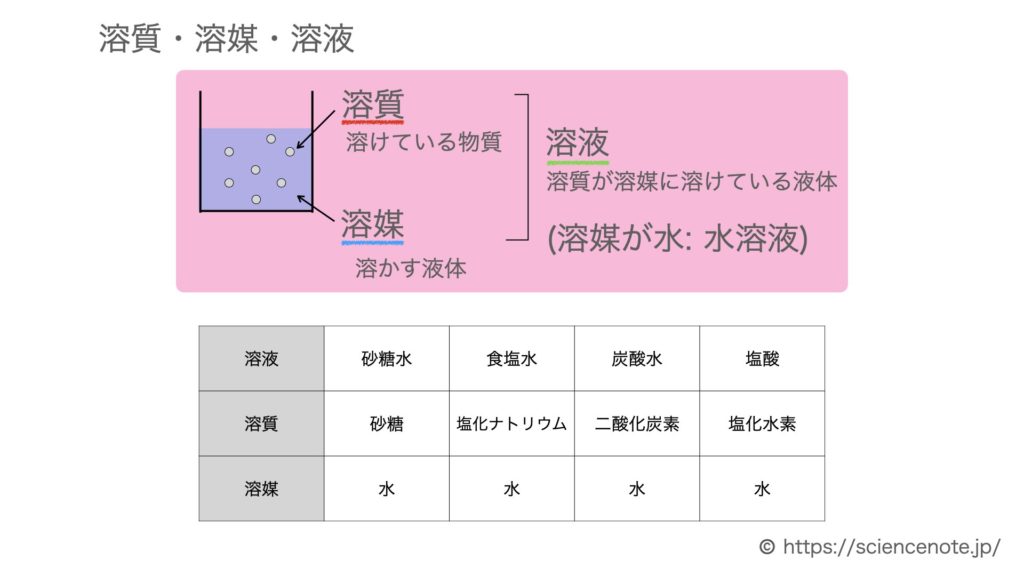
- 溶質…溶けている物質 (例)砂糖
- 溶媒…溶かす液体 (例)水
- 溶液…溶質が溶媒に溶けた液体 (ココア)
- ※溶媒が水のとき,水溶液という.
では、炭酸水の溶質と溶媒はどうなるでしょうか?
炭酸水の溶質と溶媒
- 溶質: 二酸化炭素
- 溶媒: 水
- 水溶液:炭酸水
砂糖水は固体の砂糖が溶けていて,炭酸水は気体の二酸化炭素が溶けています.
溶質は固体でも気体でも,液体でもどの状態でも可です.
いろいろな水溶液の溶質
質量パーセント濃度について

上図では,溶媒の量が同じでも,溶質の量が違います.
左の溶液は溶質が少ないので,うすい.
右の溶液には溶質がたくさんあるので濃くなります。
このような濃さを表すのが,質量パーセント濃度という考え方です.
質量パーセント濃度の公式と計算問題の解き方
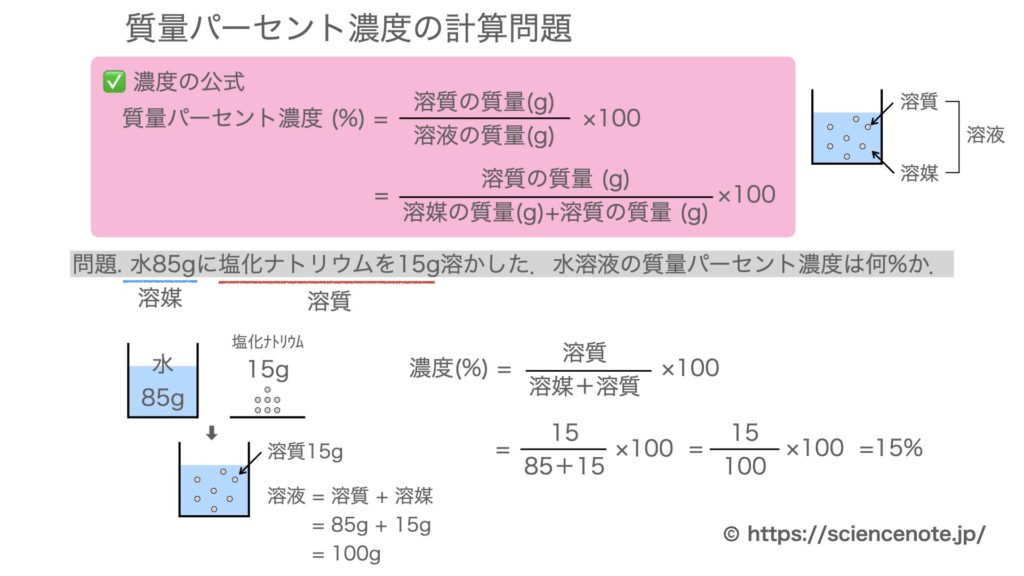
水85gに塩化ナトリウムを15g溶かした.水溶液の質量パーセント濃度は何%か
水は溶媒で85g,塩化ナトリウムは溶質で15g.
これらを合わせると,塩化ナトリウム水溶液100gできます.
したがって,
濃度 = 溶質 ÷ 溶液 ×100 = 15g ÷ 100g ×100 = 15%
となります.
テストによく出る問題
① 食塩水で,液体に溶けている物質を何というか.
② 食塩水で,溶かす液体のことを何というか.
③ 炭酸水の溶質は.
④ 塩酸の溶質は.
⑤ 食塩5gを水95gに溶かしたときの濃度は.
⑥ 食塩25gを水100gに溶かしたときの濃度は.
⑦ 20%の食塩水100gには,何gの食塩が溶けているか.
① 溶質
② 溶媒
③ 塩化水素
④ 塩化水素
⑤ 5%
⑥ 20%
⑦ 20g