ひろまる先生
この記事では,塩酸を例に電離について学習します.
また,よく出る電離式についてまとめていきます.
電離式を理解するためには,化学式やイオンを表す化学式の暗記が必要です.
電離とは.電離式まとめ10選【中学化学】
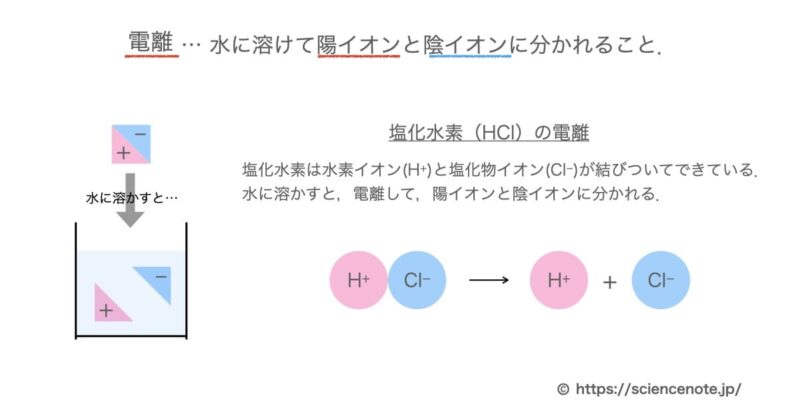
物質が水に溶けて陽イオンと陰イオンに分かれることを,電離といいます.
電離 … 物質が水に溶けて,陽イオンと陰イオンに分かれること.
例えば,塩化水素が水に溶けた塩酸の場合について考えていきましょう.
塩化水素は化学式でHClと書き,水素イオン(H+)と塩化物イオン(Cl–)が結びついてできている物質です.
この塩化水素が水に溶けると,電離して,陽イオンである水素イオンと陰イオンである塩化物イオンに分かれます.
これが塩化水素の電離です.
塩化水素の電離: HCl → H+ + Cl–
電離式(10選)
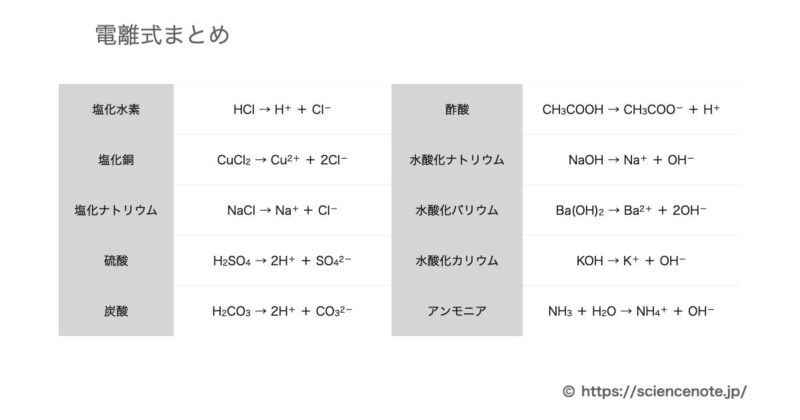
- 塩化水素(水に溶けると塩酸)
- HCl → H+ + Cl-
- 塩化銅
- CuCl2 → Cu2+ + 2Cl-
- 塩化ナトリウム
- NaCl → Na+ + Cl-
- 硫酸
- H2SO4 → 2H+ + SO42-
- 炭酸
- H2CO3 → 2H+ + CO32-
- 酢酸
- CH3COOH → CH3COO- + H+
- 水酸化ナトリウム
- NaOH → Na+ + OH-
- 水酸化バリウム
- Ba(OH)2 → Ba2+ + 2OH-
- 水酸化カリウム
- KOH → K+ + OH-
- アンモニア
- NH3 + H2O → NH4+ + OH-
電離式を理解するには,これまでに学習した化学式やイオンを表す化学式が基本になります.
合わせてこちらの記事も参考にしてください.