これまでに,電解質と非電解質について学習しました。
- 電解質
- 水に溶けると,電気を通す物質のこと.
- 水溶液中で,イオンに分かれている.
- 非電解質
- 水に溶けても,電気を通さない物質のこと.
- 水溶液中で,イオンに分かれていない.(もしくはほとんど分かれていない)
塩化銅水溶液の電気分解
塩化銅は電解質でしょうか?非電解質でしょうか?
電解質か非電解質かを見分けるポイントを覚えていますか?
それは,「水に溶けたとき,イオンに分かれる(電離する)かどうか」でした.
塩化銅の化学式から考えてみましょう.
塩化銅の化学式は,CuCl2です.
銅(Cu)と塩素原子(Cl)から出来ていると推測できます.
そうすると,塩化銅(CuCl2)が水に溶け,塩化銅水溶液になると…
CuCl2 → Cu2+ + 2Cl-
というように,銅イオン(Cu2+)と塩化物イオン(Cl-)に電離します.
したがって,塩化銅は水に溶け,電離するので,電解質です.
では,塩化銅水溶液には電流が流れますが,実際に電流を流すと何が起こるのか?についこの記事で学習していきましょう.
- 塩化銅は電解質
- 塩化銅水溶液の電離
- CuCl2 → Cu2+ + 2Cl–
【準備】塩化銅水溶液の電気分解
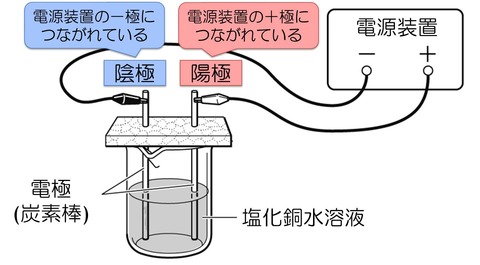
電源装置,2本の電極(炭素棒),発泡スチロール,塩化銅水溶液を準備することで実験をしていきます.
炭素棒は電気を通すので,電極として使うことができます.
(ちなみに,鉛筆の芯も炭素でできていますね)
塩化銅水溶液の電気分解では,電流を流す必要があるので,電k幻想ちが必要です.
電源装置には,プラス(+)極とマイナス(ー)極があり,電源装置の+極につながれている電極を陽極,ー極につながれている電極を陰極といいます.
- 陽極
- 電源装置の+極につながっている電極
- 陰極
- 電源装置のー極につながっている電極
【結果】塩化銅水溶液の電気分解
上記の実験装置を使って,塩化銅水溶液に電流を流すと何が起きるのでしょうか?
陽極では,泡が発生しました.
陰極では,赤褐色の物質が電極に付着していきました.
これらの結果から,それぞれの物質が何なのか?を考えていきましょう.
陽極での反応
泡が発生したことより,発生した物質が「気体」であることがわかります.
気体を集めて,色のついているろ紙を近づけました.
そうすると,ろ紙の色が脱色しました.
その結果から,発生した気体は「塩素」ということがわかります.
また,塩素は水に溶けやすいので,泡が発生してもすぐに溶ける場合があります.
- 気体が発生
- 色のついたろ紙が脱色
- 発生した気体は「塩素」
陰極での反応
赤褐色の物質が付着したことより,発生した物質が「固体」であることがわかります.
この固体を集めて,乳棒でみがくと,金属光沢がありました.
また,電流を通すこともわかりました.
さらに,叩けば,延びたり,平らになることもわかりました.
赤褐色で金属の性質を持つことから,発生した固体は「銅」ということがわかります.
- 赤褐色の固体が付着
- 金属の性質
- 発生した固体は「銅」
【まとめ】塩化銅水溶液の電気分解
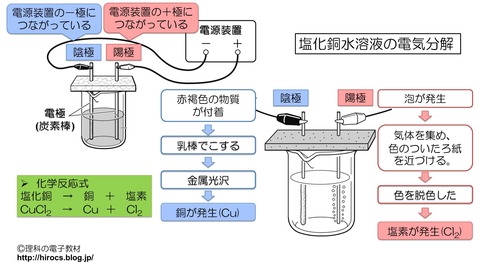
以上をまとめると,塩化銅水溶液の電気分解では,銅と塩素が発生します.
塩化銅の化学式は「CuCl2」なので,なんとなく「銅」と「塩素」が発生するかな?と予測できれば素晴らしいですね.
塩化銅水溶液の電気分解
- 陽極
- 色のついたろ紙が脱色
- 塩素が発生
- 陰極
- 赤褐色の固体
- 金属の性質
- 銅が付着
- 化学反応式
- CuCl2 → Cu + Cl2



