この記事では、原子の構造とイオンに関する問題を紹介します。
特に、原子からどのようにイオンができるのか?については頻出なので、しっかり理解して覚えてください。
また、イオン式は、これ以降の電池や電気分解、中和の理解を深めるために使います。
原子の構造とイオンに関するよく出る問題
以下の図に関する問題に答えよ。
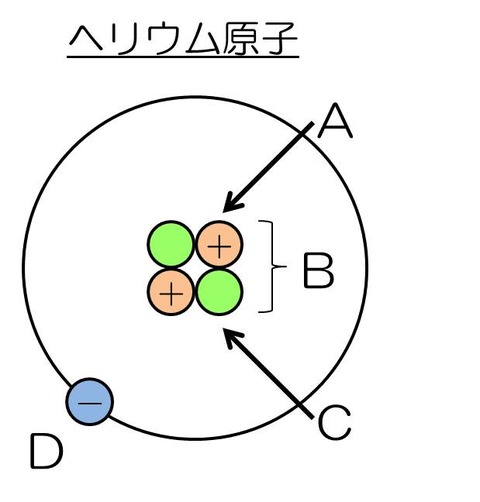
- 図のA~Dの名称を答えよ。
- 原子をつくる、プラスの電気をもつ粒を何というか。
- 原子をつくる、マイナスの電気をもつ粒を何というか。
- 原子核をつくる、プラスの電気をもつ粒を何というか。
- 原子核をつくる、マイナスの電気をもつ粒を何というか。
- 原子がプラスもしくはマイナスの電気をもつ粒を何というか。
- 原子が電子を受け取ることでできるイオンは何か。
- 原子が電子を失うことできるイオンは何か。
- ナトリウム原子は、電子を受け取りやすいか、失いやすいか。
- 塩素原子は、電子を受け取りやすいか、失いやすいか。
以下のイオン式を答えよ。
解答
- 水素イオン
- ナトリウムイオン
- 銅イオン
- バリウムイオン
- アンモニウムイオン
- 塩化物イオン
- 水酸化物イオン
- 硫酸イオン
解答
- A:陽子、B:原子核、C:中性子、D:電子
- 原子核
- 電子
- 陽子
- 中性子
- イオン
- 陰イオン
- 陽イオン
- 電子を失いやすい
- 電子を受け取りやすい
イオン式
- H+
- Na+
- Cu2+
- Ba2+
- NH4+
- Cl–
- OH–
- SO42-
原子の構造
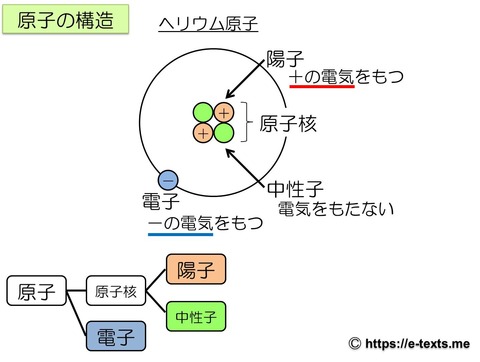
上図は原子の構造を示した図です。
原子は原子核と電子からできています。
さらに、原子核は陽子と中性子からできています。
陽子はプラス(+)の電気をもち、中性子は電気をもたないため、原子核はプラス(+)の電気をもつことになります。
また、電子はマイナス(-)の電気をもちます。
つまり、原子全体としては電気をもちません。
これを、電気的中性といいます。
イオンのでき方
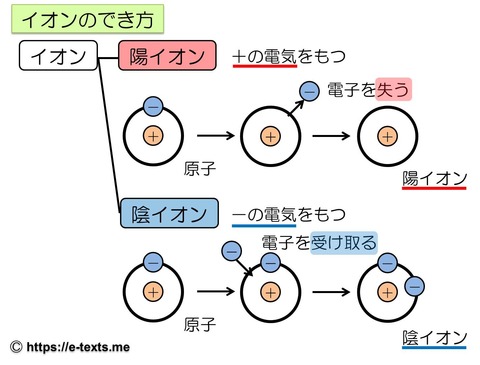
上図はイオンのでき方を示した図です。
イオンは、プラスやマイナスの電気をもった小さな粒です。
プラスの電気をもったイオンを陽イオン
マイナスの電気をもったイオンを陰イオン
といいます。
そして、原子が電子を失ったり、受け取ったりすることでイオンになります。
イオンのでき方はよく出題されるため、以下のまとめを必ず覚えてください。
イオンのでき方まとめ
・陽イオン…プラスの電気をもつイオン
・原子が電子を失うことで、陽イオンになる。
・陰イオン…マイナスの電気をもつイオン
・原子が電子を受け取ることで、陰イオンになる。
・原子が電子を失うことで、陽イオンになる。
・陰イオン…マイナスの電気をもつイオン
・原子が電子を受け取ることで、陰イオンになる。
覚えておくべきイオン式
- 水素イオン H+
- ナトリウムイオン Na+
- 銅イオン Cu2+
- バリウムイオン Ba2+
- アンモニウムイオン NH4+
- 塩化物イオン Cl–
- 水酸化物イオン OH–
- 硫酸イオン SO42-
余裕があれば覚えたいイオン式
- 亜鉛イオン Zn2+
- マグネシウムイオン Mg2+
- カリウムイオン K+
- 酢酸イオン CH3COO–
- 炭酸イオン CO32-
- 硝酸イオン NO3–
- 酸化物イオン O2-
- 硫化物イオン S2-