これまでに,電解質と非電解質について学習しました.
- 電解質
- 水に溶けると,電気を通す物質.
- 水溶液中で,電離している.
- 非電解質
- 水に溶けても,電気を通さない物質.
- 水溶液中で,電離していない.
塩酸の電気分解
塩酸は電解質でしょうか?非電解質でしょうか?
電解質か非電解質かを見分けるポイントは,「水に溶けたとき、電離するかどうか?」です.
電離とは,陽イオンと陰イオンに分かれることです.
塩化水素と塩酸の違い
塩酸の電気分解と考える前に,「塩化水素」と「塩酸」の違いを整理しておきましょう.
| 塩化水素 | 塩酸 | |
| 状態 | 気体 | 液体 (溶媒:水) |
| 化学式 | HCl | HCl |
上の表のように,気体である塩化水素を水に溶かすと塩酸になります.
したがって,塩化水素と塩酸の化学式は同じ「HCl」で表すことになります.
塩酸の電離
塩化水素が水に溶けると塩酸になります.
では,水溶液中ではどうなっているのでしょうか?
実は,塩化水素が水に溶けると,
HCl → H+ + Cl–
というように,水素イオン(H+)と塩化物イオン(Cl–)に電離します.
したがって,塩酸は電解質であり,電気を通します.
では,塩酸に電気を通すとどうなるか?を考えていきましょう.
- 塩化水素は電解質
- 水に溶けると,塩酸
- 電離式
- HCl → H+ + Cl–
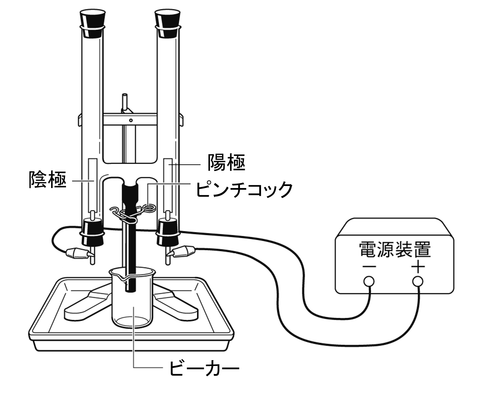
【実験器具】塩酸の電気分解
電気を流すために,「電源装置」を使います.
電源装置には,プラス(+)極とマイナス(ー)極があります.
ここで,電源装置のプラス(+)極につながれている電極を陽極,
マイナス(ー)極につながれている電極を陰極といいます.
| 電源装置 | 電極 |
| プラス極 (+極) | 陽極 |
| マイナス極 (ー極) | 陰極 |
【結果】塩酸の電気分解
塩酸に電気を流すと,陽極と陰極から泡が発生しました.
泡が発生したということは,気体が発生したことになります.
また,発生した泡の量は,陰極の方が多く,陽極では少ないという結果でした.
では,陽極と陰極でどんな気体が発生したか確認していきましょう.
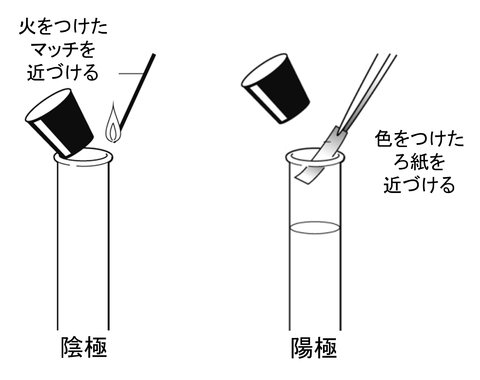
陰極で発生した気体
陰極で発生した気体に,火のついたマッチを近づけました.
その結果,音を立てて燃えました.
これから,発生した気体は「水素」ということがわかります.
陽極で発生した気体
陽極で発生した気体に,色のついたろ紙を近づけました.
その結果,色が脱色しました.
また,プールを消毒したときのようなにおいがしました.
これから,発生した気体は「塩素」ということがわかります.
- 陰極で発生した気体
- 火のついたマッチを近づけた
- 音を立てて燃えた
- 水素が発生
- 陽極で発生した気体
- 色のついたろ紙を近づけた
- 色が脱色した
- 刺激臭があった
- 塩素が発生
発生した気体の量の違い
発生した気体の量は,陰極が多く,陽極が少ない結果でした.
陰極では,水素が発生しました.
水素は水に溶けにくい気体です.
一方,陽極では塩素が発生しました.
塩素は水に溶けやすい気体です.
つまり,発生した気体の量に違いがあるのは,水への溶けやすさに違いがあるからです.
今回,塩素は水に溶けやすいので,発生した気体の量が少なく見えるということになります.
実際には,同じ量が発生しています.
この塩酸の電気分解の化学反応式は,
2HCl → H2 + Cl2
となります.
- 塩酸の電気分解
- 陰極:水素が発生
- 陽極:塩素が発生
- 化学反応式
- 2HCl → H2 + Cl2
【まとめ】塩酸の電気分解
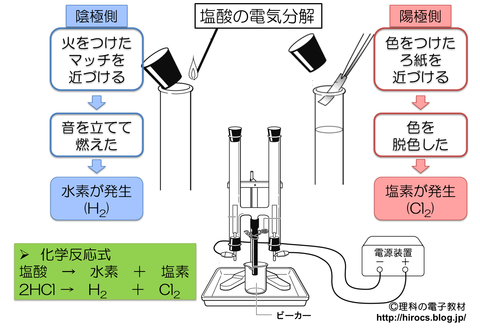
今回学習した塩酸の電気分解について上の画像で復習しましょう.
ポイントは,陽極,陰極でどの気体が発生するか?です.
また,発生した気体の性質も覚えておきましょう.